日期:2020/10/16
杂志:Cell (PERSPECTIVE)
杂志影响因子:38.6
原文标题:Functional Long Non-coding RNAs Evolve from Junk Transcripts
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(20)31244-7
来源:多伦多大学 和 NIH
摘要
转录组研究揭示了基因组的复杂性和普遍性。 尽管对于大多数(如果不是全部)这些转录本的功能存在争论,对全基因组选择性限制的分析表明,大多数产生的RNA都是垃圾片段,然而并非如此。 相反, 是促进机体复杂性的许多新型功能实体(例如lncRNA)。
内容
尽管将人类基因组的四分之一至三分之一左右转录成前mRNA,但是在去除内含子后,总共只有约1.9%的基因组序列被整合到成熟的mRNA中。除了这些规范的蛋白质编码基因和完善的RNA基因(例如rRNA,tRNA和小核RNA [snRNA])之外,其余大部分基因组都被转录成非编码RNA,尽管含量很低。除了这些非规范的转录本外,还产生了与蛋白质编码基因重叠的其他转录本,包括内含子片段,反义转录本或与5'和3'非翻译区(UTR)重叠但缺乏规范的开放阅读框(ORF)的转录本 。 许多其他基因是从基因组的增强子或其他开放区域产生的。 总的来说,似乎在某些时候,在某些细胞谱系中,在人类中,甚至在所有真核生物中,几乎整个基因组都以RNA的形式表达。
在过去的十年中,关于通过普遍转录产生的长非编码RNA(lncRNA)是否起作用的问题一直存在激烈的争论。 传统上,lncRNA被定义为超过200个核苷酸(nt)的转录本,不编码可识别的蛋白质。然而200 nt的长度截断或多或少是任意的(不是很严谨的),因此本文有效地讨论了不编码蛋白质的且不属于已知的小型非编码RNA之一(例如microRNA)的所有RNA。 (miRNA)或小核仁RNA(snoRNA)。 最近的一些研究表明,许多这样的转录本实际上被翻译成短蛋白或肽,但尽管如此,绝大多数lncRNA确实是非编码的。
目前的争论是,这些nocoding RNA 是否是功能性的。功能性lncRNA偶尔会通过类似于构造性中性进化(CNE)的机制从大量的非功能性垃圾RNA中进化出来。 因此,仅那些产生大量垃圾RNA的生物也将具有许多功能性lncRNA。总体而言,lncRNAs的保守性远低于mRNA的UTR(ENCODE Project Consortium等,2007; Ponting,2017),原则上可以预期其在类似的限制下进化(Koonin和Wolf,2010)。 而且,大多数人类lncRNA积累点突变,插入和缺失(indels)的速率与大多数缺乏功能的一致。这种弱的保守性表明许多带注释的lncRNA是无功能的。 根据这些观察结果,已表明lncRNAs具有固有的可塑性,可能不需要高度保守即可发挥作用。逆转上述趋势对抗lncRNA出现的真核生物基因组中的弱选择机制的第二个重要含义是生物化学活性但非功能性实体的不断出现。 基因组经历的一系列突变不断产生具有生化活性的短基序,包括转录因子结合和RNA聚合酶募集,从而产生了隐秘的转录起始位点。考虑到转录因子结合位点通常很短,这不足为奇(Stewart等,2012),并且许多随机的DNA片段可以激活转录。
真核生物中特别是动植物中极其丰富的转座因子(TEs)进一步加剧了真核生物基因组的固有噪声。这些自私的DNA元件会自我复制,并且随着时间的流逝,大多数会失活构成了我们基因组DNA的大部分。在非常大的基因组中(例如,蝾螈具有人类DNA数量50倍的times),TE所占的比例甚至更高。确实,人们普遍认识到,基因组扩展在很大程度上受TE活性的驱动。在某些情况下,全基因组重复和多倍性可以进一步扩展基因组,但是,这种情况极为罕见,尤其是在脊椎动物中。TEs通常带有转录因子结合位点和转录起始位点,因此促进了非特异性,混杂的转录。 确实,已经观察到许多lncRNA及其启动子均来自TE。通常识别短的简并DNA基序的转录因子不仅会结合基因调控区域,而且会结合基因组中的许多其他非功能性位点。
蛋白质编码RNA包含加工信号,包括5'和3'剪接位点基序和内含子分支点,这些信号经过一定程度的选择才能使剪接体募集到新生的转录本上。这些位点的利用通过外显子和内含子中的相邻剪接信号增强。相反,垃圾RNA通常缺乏强大的加工信号和其他促进细胞核外输出的功能。
RNA聚合酶II是合成pre-mRNA的主要转录酶,其C末端域(CTD)已知会募集染色质修饰酶,进而改变转录的DNA的包装。随着RNA聚合酶II离开启动子区域,其CTD被磷酸化,从而使其能够募集染色质修饰酶,从而将二甲基化标记沉积在基因5'端的组蛋白H3的赖氨酸4上(H3K4me2)。然后,随着RNA聚合酶在转录延伸过程中穿过基因主体,CTD获得了其他磷酸化标记,这些磷酸化标记又募集了第二组染色质修饰酶,这些酶在赖氨酸36上甲基化组蛋白H3(H3K36 methylation)。这些修饰反过来募集了组蛋白脱乙酰基酶,最终阻止了基因体内的起始位点的转录。
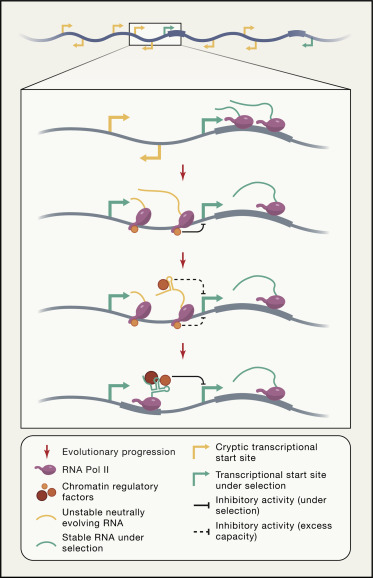
图1
大多数增强子和一些启动子区域的核小体密度低,并且包含大量转录因子结合位点,可促进依赖RNA聚合酶II的转录,从而产生被称为增强子RNA(eRNA)或启动子上游转录子的非编码RNA,解释了增强附近基因转录的lncRNA的出现。大多数eRNA被RNA质量控制机制迅速丢弃,因此寿命短。
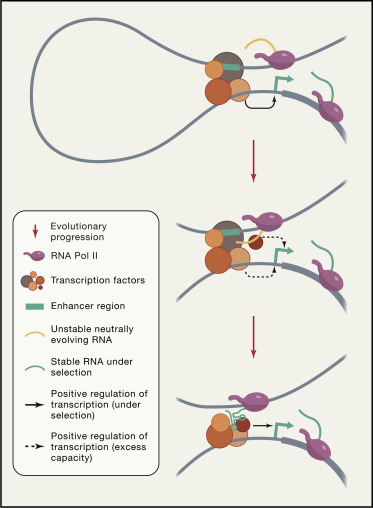
图2
全基因组研究表明,eRNA合成水平与局部mRNA合成水平相关。 尽管eRNA往往很短,但也有一些eRNA很长; 一些是从两条链合成的,而另一些则是从单条链合成的; 一些是聚腺苷酸化的,而另一些则不是。由于这些原因,eRNA和lncRNA之间的区别仍然模糊。eRNA在增强子功能中的作用(如果有)仍存在争议。 在某些增强子中,eRNA似乎是完全不需要的。在某些增强子中,eRNA似乎是完全可有可无的(Hah等人,2013; Paralkar等人,2016; Rahman等人,2017),而在其他情况下(例如Upperhand,Irg1 eRNA和Ifnar2 eRNA) ,它们是RNA聚合酶II依赖性转录的副产物,可在增强子激活过程中重塑染色质。据报道,其他eRNA,例如KLK3e,FOXC1 eRNA和AS1 eRNA,可通过介导基因loop环直接促进附近基因的激活。而有人发现诸如Bloodlinc之类的基因会激活甚至与各个增强子没有物理连接的基因。














